Qualité
Garantir la qualité des médicaments et des fournitures médicales que nous proposons est au cœur du travail d’IDA Foundation depuis sa création en 1972. Nous estimons que les prestataires de santé, où qu’ils soient dans le monde, doivent pouvoir compter sur la qualité des produits administrés. Notre équipe du service Qualité réalise des audits de nos fournisseurs et les conseille afin de nous permettre de proposer des produits et des services en lesquels nos clients peuvent avoir confiance.
Notre processus d’assurance qualité ne s’arrête pas à l’agrément d’un site de fabrication ou d’un produit précis. Nous poursuivons l’évaluation de nos fournisseurs par un processus de vérification et de suivi constant.
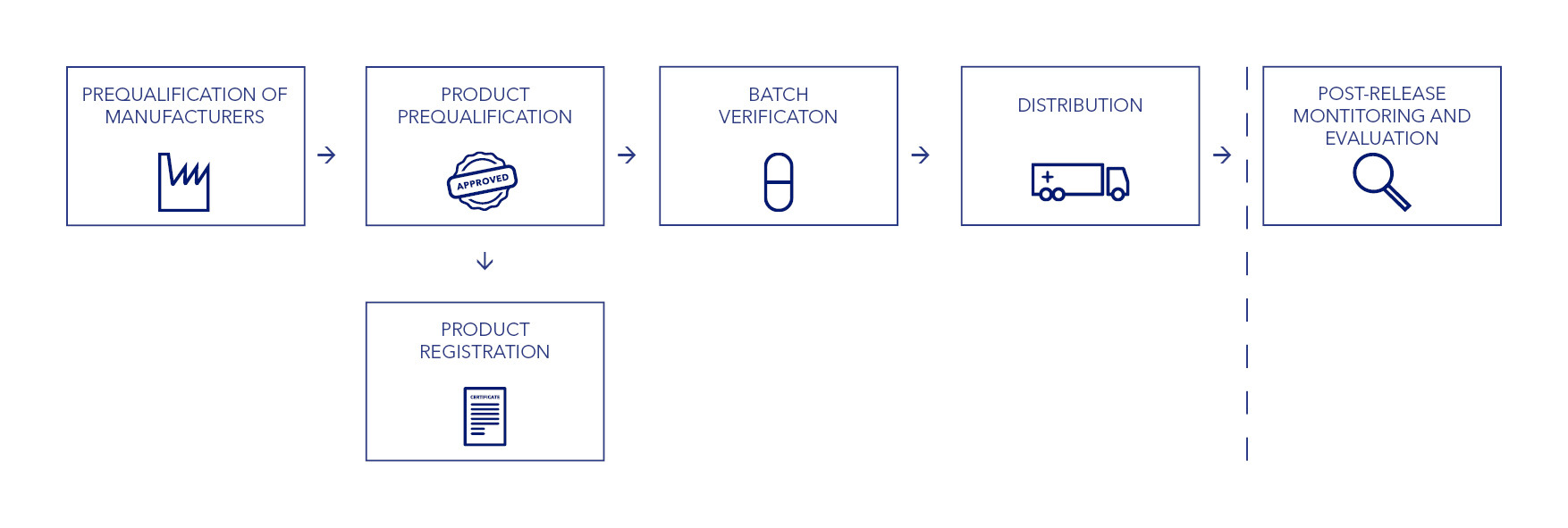

Pour accroître notre efficacité et éviter les tâches redondantes, IDA reconnaît les audits réalisés dans les sites de fabrication par les équipes de préqualification de l’OMS (PQ) ou par les autorités de règlementation. Les produits préqualifiés par l’OMS ou approuvés par des autorités de règlementation ne sont pas soumis à l’intégralité de la procédure d’approbation. Pour ces produits, nous effectuons un certain nombre de vérifications permettant d’assurer qu’ils sont conformes aux spécifications de l’autorité de règlementation ou de l’OMS.
CERTIFICATIONS
Le service Qualité d’IDA regroupe des équipes qui travaillent dans nos bureaux d’Amsterdam (Pays Bas), de Bombay (Inde), Dubai (Emirats Arabes Unis) et de Shijiazhuang (Chine). Ces équipes coopèrent étroitement pour maintenir les certifications d’IDA et assurer que notre organisation produit constamment d’excellents résultats. Les certifications actuelles de l'IDA sont présentées ci-dessous.

Registration
IDA Foundation s’appuie sur une équipe de professionnels spécialisés dans les questions de règlementation à Bombay. Les membres de cette équipe sont familiers des systèmes règlementaires et de leurs exigences, ce qui leur permet de préparer des dossiers spéciaux par pays pour les produits fournis par IDA. Une fois le processus d’enregistrement en cours, ils suivent sa progression jusqu’à ce que le produit reçoive son autorisation de mise sur le marché dans le pays de destination. L’équipe apporte également son assistance lors des changements postérieurs à la mise sur le marché et pour toutes les questions administratives relatives à l’enregistrement.
Au cours de ces dernières années, IDA Foundation a constaté une exigence croissante en matière d’enregistrement des médicaments importés. Parfois, cette exigence est justifiée par le pays de destination, comme lorsqu’une autorité nationale de règlementation définit des critères spécifiques d’enregistrement pour les produits pharmaceutiques et leur conditionnement. Les bailleurs de fonds, tels que le Fonds mondial, accordent une grande importance à l’enregistrement afin d’assurer la qualité des produits et de créer une liste nationale standardisée pour les médicaments.